C(sp3)−H键的对映选择性官能化反应为合成具有复杂结构的手性分子以及拓展化学空间提供了前所未有的机遇。手性过渡金属催化剂的开发受到了越来越多的关注,涌现了一系列高效的不对称合成方法。手性配体作为其重要组成部分,是控制反应对映选择性的关键因素。近年来,有机化学家们已经合成出大量高效的优势手性配体,并将其应用于C(sp3)−H键的不对称官能化反应。值得一提的是,过渡金属催化实现C(sp3)−H键不对称官能化反应的另一途径是利用金属中心的手性。已有研究表明,八面体金属中心(如锰、钌和铁)手性能够对映选择性地识别不同的C(sp3)−H键,因此无需手性配体。然而,当前人们对同时具有金属中心手性和配体手性的过渡金属催化剂在C(sp3)−H键不对称官能化反应的立体控制原理尚未充分研究。最近,娱乐城
理论化学研究所/超分子结构与材料全国重点实验室的钟荣林/苏忠民团队与京都大学触媒·电池元素战略研究基地的Shigeyoshi Sakaki(榊茂好)教授在前期合作研究基础上(J. Am. Chem. Soc.2019,141, 9854.;J. Am. Chem. Soc.,2020,142, 16732.;ACS Catal.,2022,12, 4880.;Angew. Chem. Int. Ed.2023, e202300704;Inorg. Chem.2024, 63, 17626.;J. Org. Chem.2024, 89, 18047.),从理论与计算化学角度研究了一例铱催化环状胺类α-位的不对称碳氢键硼化反应,详细揭示了铱中心手性与配体手性协同的立体诱导机制(图1),相关研究成果以全文形式发表在近期的J. Am. Chem. Soc.期刊上。
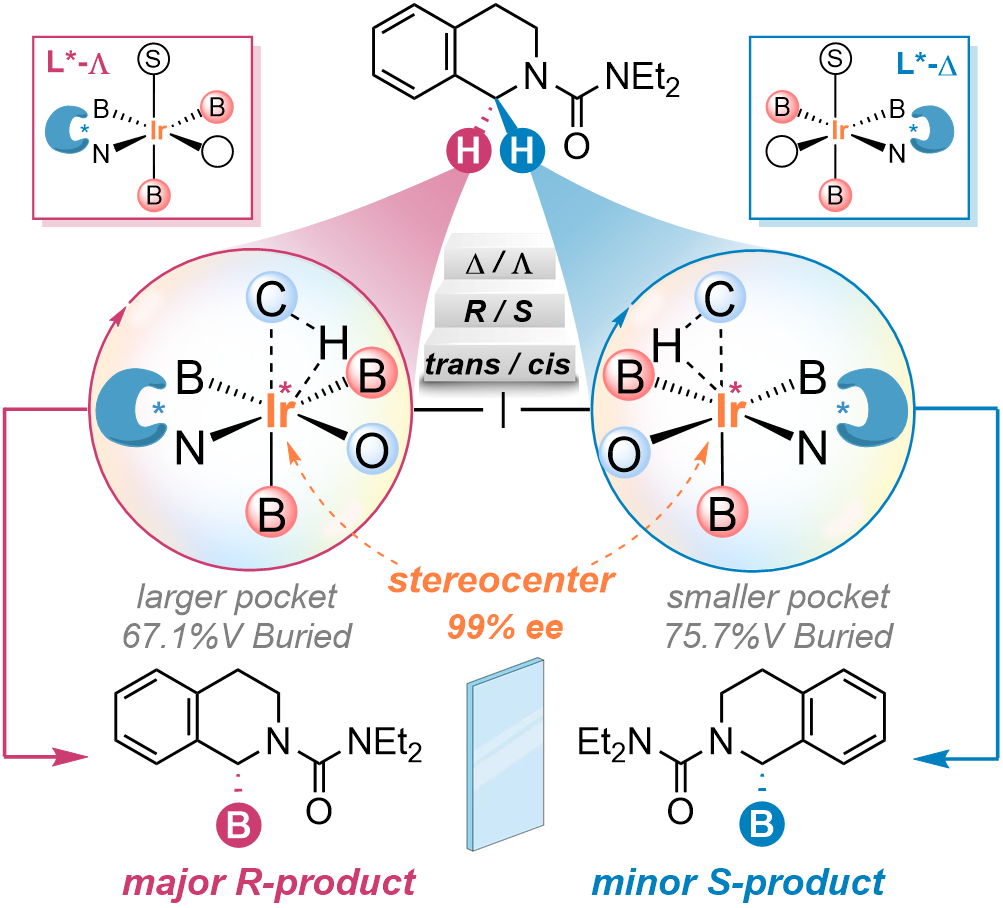
图1.金属中心手性与配体手性协同的立体诱导机制
研究结果表明,原位互变的铱中心手性(Λ或Δ)和配体绝对手性(S,S)的协同会产生两个非对映异构的活性物种,分别为R-和S-硼化产物的形成提供了各自的手性环境。其中,(S,S)-Λ可以识别C(sp3)−HR键,而(S,S)-∆则会识别C(sp3)−HS键,分别产生R-和S-硼化产物。进一步,确定了决速步骤是B−C键还原消除。基于上述立体诱导模型,作者采用谐振势限制的分子动力学模拟(MD)方法对决速步骤的过渡态结构进行了构象空间的完备性采样,统计了一定能量范围内R-和S-过渡态不同构象的贡献,计算得到的ee值为98%,有利于生成R-硼化产物,较好地吻合实验结果(R, 94%ee)。通过对构象立体结构的统计分析,揭示了反应口袋的大小差异是导致对映选择性差异的主要原因。同时,该立体诱导模型能够成功复现实验观察到的远端非手性位点取代基依赖的对映选择性变化,但忽略铱中心手性无法复现这一配体取代基效应。
这项工作揭示了金属中心手性与配体手性的协同在C(sp3)−H键对映选择性硼化反应中发挥的重要作用,理清了不对称催化反应体系中多个立体因素导致的复杂手性诱导关系,为将来更好地理解对映选择性的起源并设计新型不对称催化反应提供了新视角。
论文连接
//doi.org/10.1021/jacs.5c10820